摘要:异基因造血干细胞移植(allo-HSCT)是一种对血液系统恶性肿瘤有潜在治愈性的治疗方法。国际ALL试验(MRC UKALL XII/ECOG E2993)的最终结果表明,标准风险ALL成人患者的最大获益来自于首次完全缓解(CR)时同胞相合...

异基因造血干细胞移植(allo-HSCT)是一种对血液系统恶性肿瘤有潜在治愈性的治疗方法。国际ALL试验(MRC UKALL XII/ECOG E2993)的最终结果表明,标准风险ALL成人患者的最大获益来自于首次完全缓解(CR)时同胞相合allo-HSCT,但20%-40%在首次CR时进行allo-HSCT的患者仍会复发。由于传统治疗方案的疗效有限,且目前尚无标准治疗方法,造血干细胞移植(HSCT)后复发的ALL患者预后不佳,疾病复发是患者死亡的主要原因。因此,迫切需要为HSCT后复发的ALL患者提供安全有效的新疗法。
作为一种有效的新型免疫疗法,嵌合抗原受体(CAR)T细胞疗法可使复发/难治性B-ALL患者获得较高的初始反应率和长期缓解。最近有研究显示,异基因CD19 CAR-T细胞疗法可诱导HSCT后复发患者达到CR而不会引发移植物抗宿主病(GVHD),可显著提高患者的长期生存,但仍需进一步研究。同时已有研究证实,连续输注CAR19/22 T细胞可以减少白血病抗原丢失引起的复发,在难治/复发性B细胞恶性肿瘤患者中有高度活性且耐受性良好。因此,来自华中科技大学同济医学院附属同济医院的研究者团队进行了一项回顾性研究,探索连续输注抗CD19和抗CD22 CAR-T细胞(两个单靶点三代CAR-T的鸡尾酒疗法)在allo-HSCT后复发的ALL患者中的疗效和安全性。
研究方法
研究纳入标准:(1)根据世界卫生组织肿瘤分类诊断为B-ALL;(2)allo-HSCT后复发;(3)经流式细胞术或免疫组织化学证实的恶性B细胞上CD19和CD22双重表达;(4)良好的体能状态(东部肿瘤合作组体能状态评分≤2),器官功能基本正常;(5)当供体T细胞不可用时,患者外周血T细胞的嵌合体分析>95%供体嵌合体。
根据CAR-T细胞的制造和患者的情况确定CAR-T细胞输注时间。所有患者均接受FC淋巴细胞清除化疗(氟达拉滨25mg/m2联合环磷酰胺300mg/m2,第-4至-2天)。根据转染效率和制造后20天内可用细胞的产量确定CAR-T细胞的剂量。将CAR19和CAR22 T细胞分两次剂量分别给予,并连续几天输注。细胞输注的第一天设定为研究第0天。根据患者的具体情况处理CAR-T细胞输注后的不良反应。在CAR-T细胞输注后30天内进行骨髓检查,且每1-3个月评估患者反应。
研究结果
01 患者特征
2016年7月1日至2020年7月1日,共有23例allo-HSCT后复发的B-ALL患者接受CAR19/22 T细胞鸡尾酒疗法,并参与分析。数据收集截止时间为2020年12月30日。患者的中位年龄为29岁(范围,16-49岁)。患者特征详见表1。
表1

02 临床结果
在CAR-T输注后30天内接受疗效评估的23例患者中,22例达到MRD阴性CR和骨髓嵌合恢复。1例患者(患者16)拒绝接受评估,并在输注后3.5个月死于无法控制的疾病进展。
在CAR-T输注后获得CR的22例患者中,有7例(31.8%)复发,包括2例髓外复发和5例髓内复发。7例复发患者中,5例因双重抗原阳性而复发(CD19和CD22的MFI比率均≥1.5),其中3例患者通过二次CAR-T输注和酪氨酸激酶抑制剂(TKI)的早期干预(患者1)存活,另外2例死亡;2例患者因CD19阴性(MFI比率降低<1.5)和CD22抗原指数降低而复发,其中1例通过联合应用西达本胺和普纳替尼获得二次缓解,另1例患者死亡。
在输注CAR-T细胞之前和输注后的多个时间点,通过ddPCR从外周血中检测到CD19和CD22 CAR-T细胞的存在。CD19和CD22 CAR-T细胞的中位持续时间分别为10.9和9.0个月。所有患者在输注CAR-T细胞后均出现B细胞再生障碍,并由此产生低丙种球蛋白血症,中位持续时间为12.6个月。在3例B细胞早期恢复(<6个月)的患者中,1例复发,其余2例被认为复发风险高并接受了早期干预。
中位随访14.7个月(范围 3.0-51.9),整个队列的中位无进展生存(PFS)为25.2个月(95%CI,2.9-47.5),中位总生存期(OS)未达到。预估12个月PFS率为59.2%(95%CI,35.9%-76.5%),12个月OS率为67.4%(95%CI,43.2%-83.1%)(图1)。
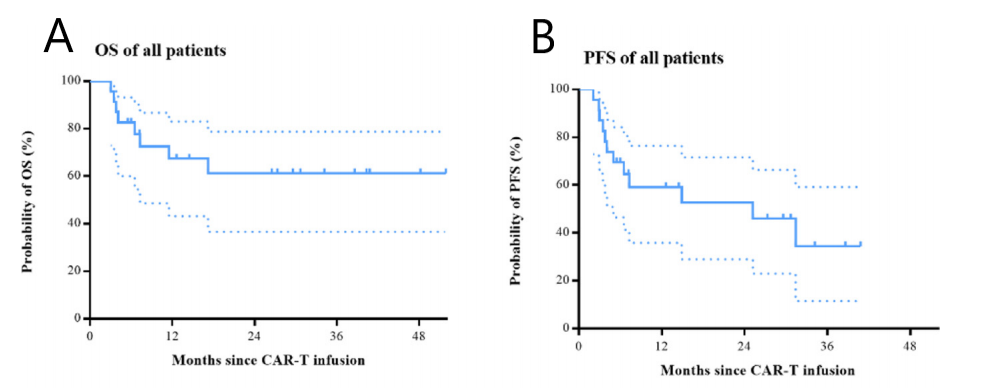
图1
HSCT后早期复发(≤6个月)的患者OS更差(P=0.018,图2A)。同样,CAR-T输注后严重感染(≥3级)患者的OS显著降低(P=0.027,图2B)。
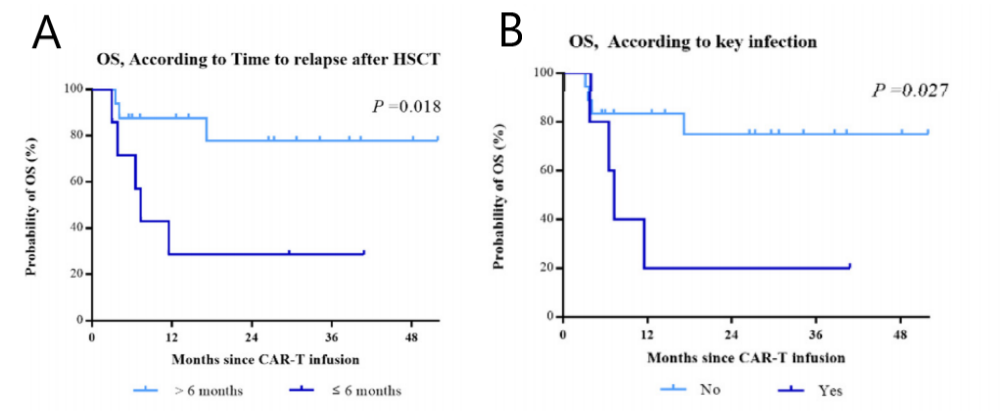
图2
此外,尽管症状大多较轻,可通过抗GVHD治疗加以控制,但CAR-T输注后发生GVHD的患者预后较差(OS,P=0.002;PFS,P=0.007,图3)。
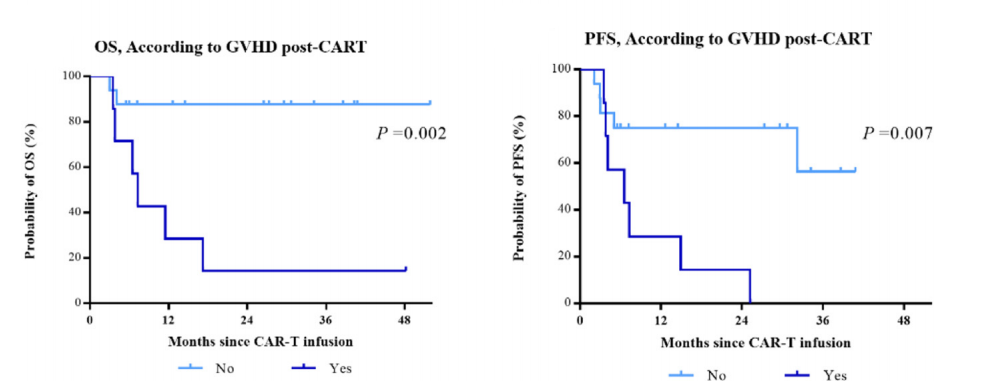
图3
03 安全性分析
CAR-T细胞输注后第1个月内最常见的严重AE(≥3级)为血细胞减少。22例(95.7%)患者在输注后出现发热,其中≥3级的患者应用糖皮质激素和托珠单抗后发热得到控制。其他AE,如低氧血症、低血压、窦性心动过速、低蛋白血症、腹泻等,一般较轻。
20例(87.0%)患者经历了不同等级的细胞因子释放综合征(CRS),但大多数为轻度(1级,12例;2级,6例;3级,2例),未出现4/5级CRS。血清白细胞介素-6(P=0.002)和C-反应蛋白水平在CRS期间升高,并与CRS等级相关。供体类型、CAR-T细胞来源、移植后早期复发(≤6个月)或肿瘤负荷等变量均不影响CRS的等级。4例(17.4%)患者出现CAR-T细胞相关脑病综合征(CRES),其中2例出现嗜睡症状(1级),1例出现头痛(1级),1例出现意识障碍(2级)。通过对症治疗、糖皮质激素、托珠单抗和血浆置换,所有CRS和CRES均可逆。
7例患者在CAR-T治疗后发生GVHD,包括5例aGVHD和2例cGVHD。除1例患者死于严重不可逆肝脏cGVHD,其余6例通过糖皮质激素、环孢素、霉酚酸酯和芦可替尼的联合治疗后GVHD得到有效控制。供体类型(P=0.089)和CAR-T细胞来源(P=0.176)与CAR-T输注后的GVHD无相关性。
5例患者在CAR-T输注后30天内发生感染,包括2例严重感染(≥3级),主要为上呼吸道感染和肺部感染,通过升级抗生素和对症支持治疗逐渐缓解。在随访期间,5例患者出现严重感染,包括2例巨细胞病毒肺炎和3例混合性肺部感染(主要为真菌和细菌感染)。2例患者死于致命感染(不包括1例死于新冠肺炎)。
研究结论
研究结果表明,对于HSCT后复发的B-ALL患者,连续输注CAR19/22 T细胞是一种安全有效的治疗方法。移植后早期复发、严重感染或CAR-T输注后新发GVHD是不良预后因素。本研究仍存在一定局限性,如其单中心、回顾性设计和亚组患者数量少。因此,需要进行前瞻性、更大规模的多中心临床试验以验证本研究结果。
参考来源:
Nan Yan, Na Wang, Gaoxiang Wang, et al. CAR19/22 T cell cocktail therapy for B-ALL relapsed after allogeneic hematopoietic stem cell transplantation. Cytotherapy.2002 AUG 1; 24(8) :841-849. doi:https://acsjournals.onlinelibrary.wiley.com/doi/10.1002/cncr.34182.
编辑:siqili
审校:Mia
排版:moly
执行:moly